Von Cécile Grobet und Dr. Renato Mattli
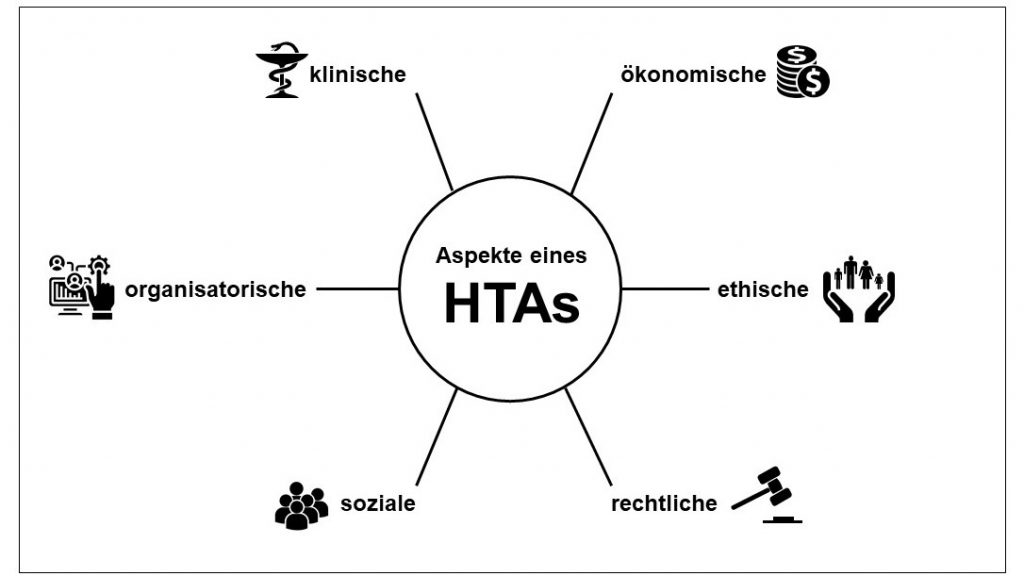
Der Einsatz von Biosimilars ist in der Schweiz deutlich weniger verbreitet als in vielen anderen Ländern Europas. Im Auftrag des Bundesamtes für Gesundheit (BAG) hat das Winterthurer Institut für Gesundheitsökonomie deshalb in einem Health Technology Assessment (HTA) wissenschaftlich untersucht, ob es dafür klinische, ökonomische, ethische, rechtliche, soziale oder organisatorische Gründe geben könnte. Die Ergebnisse unseres HTAs dienen nun der Politik zur evidenzbasierten Entscheidungsfindung.
Was sind Biologika und Biosimilars?
Biologika oder biologische Medikamente sind Arzneimittel, die aus oder mithilfe biologischer Organismen in einem aufwändigen technischen Verfahren hergestellt werden. Sie greifen gezielt in das menschliche Immunsystem ein. Den Durchbruch schafften die Biologika vor 20 Jahren und seither haben sie beachtliche Fortschritte in der Behandlung von Krebs oder Autoimmunkrankheiten ermöglicht. Aufgrund ihrer komplexen Entwicklung und Herstellung sind Biologika deutlich teurer als herkömmliche Medikamente.
Nach Patentablauf ist es möglich, Biologika zu kopieren. Diese «Kopien» heissen Biosimilars. Da ein biologisches Medikament aus Molekülen mit grosser, heterogener Struktur besteht, ist eine exakte Kopie nicht möglich. In der Schweiz müssen Biosimilars mindestens 25% günstiger sein als ihre Originalpräparate.
Biosimilars in der Schweiz und anderen Ländern
In der Schweiz werden Biosimilars bisher selten verordnet, nämlich in weniger als 10% aller Fälle, bei denen Biosimilars zur Verfügung stehen.[1] Interessanterweise konnte bei der Biosimilar-Verschreibung in der Schweiz ein grosser Unterschied zwischen den Kantonen sowie den Leistungserbringern (stationär vs. ambulant) aufgezeigt werden.[1]
Andere Länder sind in der Verschreibung von Biosimilars viel erfolgreicher. Sie haben verschiedene Massnahmen ergriffen, um die Verschreibungen zu erhöhen, z.B. Verpflichtung mit Biosimilar zu starten, Einführung eines grösseren Preisunterschieds zwischen dem Originalpräparat und dem Biosimilar oder eines höheren Selbstbehalts beim Originalpräparat. So werden in Norwegen und Dänemark fast 90 Prozent der Wirkstoffgesamtmenge durch Biosimilars abgedeckt.
Durch den tieferen Preis der Biosimilars sind offensichtlich Kosteneinsparungen möglich. Ein Bericht des WIGs aus dem letzten Jahr schätzte die Kosteneinsparungen im Schweizer Gesundheitssystem durch vermehrten Einsatz von Biosimilars auf bis zu 100 Millionen Franken über drei Jahre.[2] Auch der Helsana-Arzneimittelreport aus dem Jahre 2020 fand ein Einsparpotential durch Biosimilars von 60 Millionen Franken für das Jahr 2019.[1] In den letzten fünf Jahren hätten mit vermehrtem Biosimilar-Einsatz rund 188 Millionen Franken gespart werden können. Ein grosser Teil davon fiel auf Infliximab.[1]
Der zögerliche Einsatz von Biosimilars in der Schweiz im Vergleich zu anderen Ländern und das offensichtliche Kosteneinsparpotential waren der Grund, wieso das BAG das Thema in einem HTA untersucht lies. Der Fokus wurde dabei auf Infliximab bei rheumatoider Arthritis (RA) gerichtet.
Infliximab Biosimilars sind gleich wirksam und sicher wie das Originalpräparat
Unser Systematic Review und die anschliessend durchgeführte Metaanalyse haben gezeigt, dass die Wirksamkeit und Sicherheit beim Infliximab-Biosimilar im Vergleich zum Originalpräparat bei RA-Patientinnen und Patienten gleich waren. Dies war in beiden untersuchten Szenarien der Fall; wenn die Behandlung neu begonnen oder wenn vom Original auf das Biosimilar gewechselt wurde. Die Evidenzlage bewerteten wir als gut für den Behandlungsbeginn und als gering bis mässig für den Wechsel, da hier in den Studien unterschiedliche Untersuchungszeitpunkte und breite Vertrauensintervalle vorlagen.
Biosimilars führen zu Kosteneinsparungen
Die Analyse der Kosten zeigte, dass pro Patient/in, welche/r die Behandlung mit dem Infliximab-Biosimilar anstelle des Originalpräparates beginnt oder auf das Biosimilar wechselt, über das Restleben rund 18’000 Franken gespart werden können. Bei jährlich ca. 60 neuen RA-Patientinnen und Patienten, die für Infliximab infrage kommen, werden die Kosteneinsparungen für den Behandlungsbeginn mit dem Infliximab-Biosimilar über fünf Jahre auf ca. 1.6 Millionen Franken geschätzt. Würden die aktuell etwa 1’000 mit dem Originalpräparat behandelten RA-Patientinnen und Patienten auf das Biosimilar umsteigen, würde das über fünf Jahre zu einer Kosteneinsparung von 9.3 Millionen Franken führen.
Rechtliche und organisatorische Aspekte behindern einen breiteren Einsatz von Biosimilars
Unser HTA zeigt auf, dass die Austauschbarkeit (interchangeability) von Biologika weder im Heilmittelrecht noch im Krankenversicherungsrecht ausdrücklich geregelt ist. Der Entscheid über einen allfälligen Austausch ist nach der Rechtsprechung des Bundesgerichts in jedem Fall durch den behandelnden Arzt zu treffen, dies unter Einhaltung seiner rechtlichen Berufs- und Sorgfaltspflichten. Diese rechtliche Unsicherheit fördert den Einsatz der Originalpräparate. Aus organisatorischer Sicht scheinen die Gewinnmargen, welche vom Preis eines Produkts abhängen, einen breiteren Einsatz von Biosimilars in der Schweiz zu behindern. Da die Originalpräparate einen höheren Preis als die Biosimilars haben, besteht ein finanzieller Anreiz das Originalpräparat zu verwenden. Aus ethischer und sozialer Sicht konnten hingegen keine kontroversen Aspekte identifiziert werden.
Wie weiter?
Unser HTA ist eine wissenschaftliche und multidisziplinäre Analyse von Biosimilars spezifisch für die Schweiz. Es wurde aufgezeigt, dass mit dem Infliximab-Biosimilar bei rheumatoider Arthritis bei gleichbleibender Qualität für den Patienten Kosten eingespart werden können. Dazu müssen jedoch die rechtlichen und organisatorischen Rahmenbedingungen angepasst werden. Das HTA wird nun die Politik bei der evidenzbasierten Entscheidungsfindung unterstützen und soll helfen, geeignete Massnahmen zu definieren.
Weiter zum vollständigen HTA Report: Link
Quellen:
[1]. Schur et al. 2020; Helsana-Arzneimittelreport für die Schweiz 2020, Link
[2]. Kobler et al. 2020; Biosimilars in der Schweiz – Ein Expertenbericht des Winterthurer Instituts für Gesundheitsökonomie (WIG), ZHAW School of Management and Law. Link