Von national zu europäisch: Die Rolle der gemeinsamen klinischen Bewertung im Gesundheitswesen
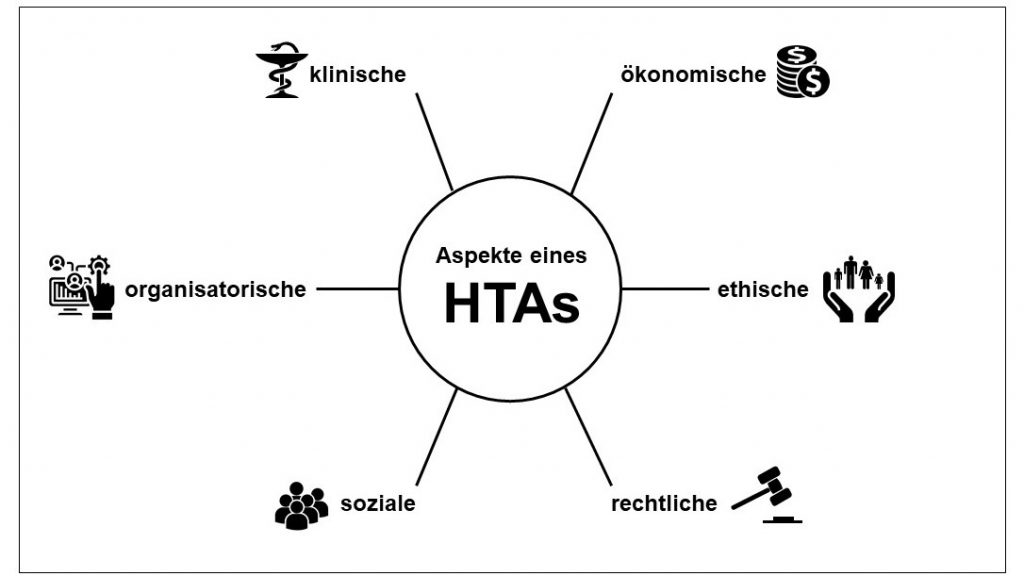
Von Cécile Grobet Mit der Verordnung (EU) 2021/2282 wurde ein einheitlicher Rahmen für die Bewertung von Gesundheitstechnologien (Health Technology Assessment, HTA) in der Europäischen Union geschaffen. Am 12. Januar 2025 sind neue Regelungen in Kraft getreten, die insbesondere die gemeinsame klinische Bewertung (Joint Clinical Assessment, JCA) von innovativen Arzneimitteln und Hochrisiko-Medizinprodukten auf EU-Ebene fördern. Ziel […]